Ювенильный остеопороз. Часть 1
- 28 ноября 2016 15:45:01
- Отзывов: 0
- Просмотров: 3164
А.А. Дударева, А.И. Метальников, Е.В. Калашникова, К.В. Лукьянов, г. Барнаул
Введение
 Метаболические процессы в костной ткани протекают с определенной скоростью. Отклонения в этих процессах в виде их ускорения или замедления приводят к нарушению физиологии костной ткани и развитию патологии. Заболевания костной ткани, связанные с нарушением ее метаболизма, выделяются в группу метаболических остеопатий. В отечественной литературе термин «остеопатия» уже с 1959 г. применялся А.В. Русаковым для обозначения изменений в костной ткани, вызванных нарушением ее обмена. Наиболее распространенной формой метаболических остеопатий является остеопороз (ОП).
Метаболические процессы в костной ткани протекают с определенной скоростью. Отклонения в этих процессах в виде их ускорения или замедления приводят к нарушению физиологии костной ткани и развитию патологии. Заболевания костной ткани, связанные с нарушением ее метаболизма, выделяются в группу метаболических остеопатий. В отечественной литературе термин «остеопатия» уже с 1959 г. применялся А.В. Русаковым для обозначения изменений в костной ткани, вызванных нарушением ее обмена. Наиболее распространенной формой метаболических остеопатий является остеопороз (ОП).
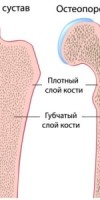
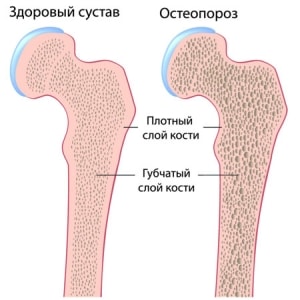
Остеопороз – системное заболевание, характеризующееся низкой массой кости и микроструктурной перестройкой костной ткани, приводящей к повышенной ломкости кости и, как следствие этого, повышению риска перелома. Это определение патологии было принято в 1990 г. на конференции по остеопорозу в Копенгагене. Уменьшение массы кости влечет за собой снижение механической прочности, поэтому переломы при остеопорозе возникают при незначительной травме или даже статической нагрузке. Частота переломов, связанных с остеопорозом, во всем мире увеличивается. Риск переломов шейки бедра на протяжении жизни у женщин белой расы составляет 15%, что приближается к уровню заболеваемости раком молочной железы, эндометрия и яичников, вместе взятых Риск перелома шейки бедра на протяжении жизни у мужчин составляет 5%, что приближается к уровню заболеваемости раком предстательной железы. Переломы шейки бедра в 20% случаев становятся причиной смерти, а 50% выживших остаются инвалидами. Каждый третий пациент с переломами этой локализации нуждается в дорогостоящих реабилитационных мероприятиях. Частота переломов тел позвонков у взрослых за последние 30 лет увеличилась в 4 раза. По данным ряда исследователей, почти 20% ортопедических приемов приходится на больных с переломами тел позвонков, возникших, главным образом, на фоне остеопороза (С.С Родионова, 1997). Не менее драматична ситуация с переломами у детей и подростков. По данным г. Барнаула, за последние 15 лет частота переломов тел позвонков у детей возросла в 6 раз, причем у 70% пострадавших механизм травмы был не адекватен тяжести повреждения. По данным Российского НИИ травматологии и ортопедии им. Вредена, анализ результатов обследования подростков с патологией позвоночника выявил у 13,95% наличие остеопороза (С А. Михайлов, 1997).
Благодаря широкомасштабным исследованиям, проводимым в ряде стран Европы и Америки, разработаны методы диагностики и лечения ОП. До окончательного решения проблемы, судя по данным литературы, еще далеко. Тем не менее, совершенно очевидно, что предотвращение потери костной массы может быть гораздо эффективнее, чем лечение осложнений остеопороза. Поэтому основной целью профилактических мероприятий в группах риска развития остеопороза является увеличение костной массы, близкой к максимуму, приобретаемому к 18-20 годам.
Анатомо-физиологические особенности костной ткани
Костная ткань является динамичной структурой, в которой постоянно, в течение всей жизни, происходят процессы образования и разрушения. В физиологии костной ткани на протяжении многих лет доминировало представление, что эти процессы происходят независимо друг от друга, то есть независимо друг от друга и их расположения функционируют остеокласты и остеобласты. Это представление подверглось сомнению, прежде всего потому, что попытки раздельного воздействия на функцию остеобластов и остеокластов привели к обратному эффекту; угнетение резорбции под влиянием фармпрепаратов приводило к угнетению образования кости. Это способствовало изменению представления о механизме самоподдержания кости и созданию теории «интермедиарной» организации скелета, стержнем которой являлось морфофункциональное понятие «базисная многоклеточная единица» (БМЕ).
БМЕ – участок костной ткани, в котором протекают сопряженные по времени процессы локальной резорбции и образования кости, что обозначается как ремоделирование. БМЕ образует остеокласты, остеобласты, активные мезенхимальные клетки, капиллярные петли. Размер БМЕ – 0,05-0,1 мм3. В организме взрослого одновременно функционирует 105х106 БМЕ. Длительность жизни БМЕ и сроки рождения или формирования новых БМЕ имеют постоянную величину, что поддерживает состояние образования и резорбции кости. Интенсивность ремоделирования достигает максимума в юношеском возрасте, затем постепенно снижается. Возрастное снижение интенсивности ремоделирования лежит в основе физиологической атрофии костной ткани. Большинство исследователей считают, что потеря массы кости в норме зависит от пола и составляет у мужчин 0,4-1,2%, у женщин 0,75-2,4% в год. Причем у женщин этот процесс начинается с 35, у мужчин с 50 лет.
Регуляторный механизм БМЕ неизвестен, но есть предположения, что основную роль при этом играют активные метаболиты витамина D. Интермедиарная организация скелета несет ответственность не только за ремоделирование, но и за моделирование (процесс, контролирующий форму и размер кости) и восстановление микропереломов. В норме в костной ткани постоянно происходят микропереломы трабекул, которые запускают механизмы ремоделирования, что, в свою очередь, способствует их заживлению.
Гомеостаз кальция
Физиология составляющих БМЕ клеток определяется биохимическими процессами, которые, в свою очередь, реагируют на воздействие системных и местных гормонов. Ключевая роль во многих биохимических процессах, протекающих в организме, отводится кальцию (Са). О значении этого элемента лучше всего говорят слова «эволюция просто не могла удержаться от того, чтобы не награждать его одной ролью за другой». Несмотря на низкую концентрацию иона Са в различных тканях (106-107 м/л), он стимулирует активность ряда ферментов, секрецию и действие гормонов, определяет проницаемость мембран, участвует в делении и дифференциации клеток, осуществляет реализацию биологического сигнала на клетках разного типа. Уровень Са во внеклеточной жидкости зависит от всасывания в кишечнике, от его включения в неорганическую фазу кости и обмена «кость-кровь». Са поступает в организм с пищей, всасывание его из кишечника в кровяное русло осуществляется с помощью специальных биохимических организмов и интенсивнее всего происходит в двенадцатиперстной кишке. В этом процессе принимает активное участие кальцийсвязывающий белок (кальбиндин), синтезируемый в энтероцитах. Индуктором биосинтеза кальцийсвязывающего белка является активный метаболит витамина D-1,25-(ОН)2D3. Из организма кальций выводится с мочой и калом, соответственно 300 и 760 мг в сутки. Почки способны сохранять Са при гипокальциемии и, в меньшей степени, освобождать организм от его избытка. Отложение Са в виде оксиапатита в скелете сложилось в процессе эволюции. Кость содержит 99% кальция. Причем часть его находится в виде стабильной фракции, которая мало связана с обменными процессами, часть – в виде лабильной фракции, участвующей в обмене. Так как в биохимических процессах клетки Са участвовал намного раньше, чем сформировался скелет, то любое нарушение его гомеостаза нормализуется за счет скелета.
Гомеостаз фосфора
25-40% фосфора взрослый человек получает с мясом и рыбой, 20-30% – с молочными продуктами и 12-20% – с хлебом. Хотя его всасывание происходит по всей длине тонкого кишечника, основное количество усваивается в тощей кишке. Главным образом всасывание происходит за счет системы Na-зависимого активного транспорта, в меньшей мере – путем пассивной диффузии. Не исключается также возможность поступления фосфора вместе с кальцием под влиянием 1,25-(ОН)2D3. Причем метаболит действует непосредственно на проницаемость мембран энтероцитов. 90% фосфора накапливается в кости. Содержание фосфора крови, в отличие от кальция, меняется в течение суток, что связывают с приемом пищи и действием паратиреоидного гормона (ПТГ). Резорбция фосфора под влиянием ПТГ происходит в проксимальных почечных канальцах. Активные метаболиты витамина D на этот процесс не влияют.
Кальцийрегулирующие гормоны
Основное регулирующее влияние на гомеостаз кальция, фосфора и метаболизм костной ткани оказывают ПТГ, активные метаболиты витамина D3, кальцитонин (КТ). Их взаимодействие осуществляется по принципу обратной связи, характерной для функционирования саморегулирующейся системы
Паратгормон
Секреция ПТГ регулируется изменением уровня ионизированного кальция в крови. Тканями-мишенями гормона являются почки и костная ткань. В клеткахмишенях ПТГ связывается со специфическими рецепторами на их мембране. Сигнал, транслируемый мембранным сопрягающим белком, активизирует аденилатциклазу, что в свою очередь приводит к образованию циклических нуклеотидов, модулирующих клеточные компоненты и их функцию. При действии ПТГ кальций экстрагируется из кости. Гормон увеличивает число остеокластов за счет ускорения созревания их клеток-предшественников и повышает их метаболическую активность ПТГ способен также оказывать влияние на функцию остеобластов. Влияние гормона на почки связано с реабсорбцией кальция и фосфора. Большинство исследователей считают, что рецепторы к ПТГ располагаются преимущественно в проксимальных почечных канальцах. С возрастом в норме продукция ПТГ увеличивается.
Витамин D
Человек получает витамин D в виде холекальциферола (D3), который вырабатывается в коже, и эргокальциферола (D2), поступающего с пищей. Суточная потребность в витамине D – 2,5 мг (100 ME). Однако ни витамин D2, ни D3 не обладают биологической активностью. Превращение витамина D в активные метаболиты представляется следующим образом. Витамин D3 в крови связывается с витамин D-связывающим белком и в таком виде транспортируется в печень, где после гидроксилирования образуется 25оксихолекальциферол (25-OH/D3). Процесс гидроксилирования происходит с участием фермента витамин D-25-гидроксилазы и весьма чувствителен к воздействию медикаментов и повреждается при гепатобилиарной патологии. Из печени 25-(ОН-)D3 поступает в кровь, где снова связывается с витамин D-связывающим белком. Это соединение представляет собой основную циркулирующую в крови форму витамина D. Второе гидроксилирование происходит в почках и, в меньшей степени, в костях, с участием фермента 1-а-гидроксилазы или 24гидроксилазы. Образуется, соответственно, активный метаболит 1,25-(ОН)2D3 (кальцитриол) и 24, 25-(OH)2D3. Наиболее изучено влияние 1,25-(ОН)2D3, который стимулирует всасывание кальция из кишечника, его реабсорбцию в почечных канальцах, обеспечивает процесс минерализации и стимулирует образование кости в участках ее резорбции.
Кальцитонин (КТ)
Являясь антагонистом ПТГ, угнетает процесс резорбции костной ткани, уменьшая число и активность остеокластов, оказывает тормозящее влияние на синтез 1,25-(ОН)20з, снижает реабсорбцию кальция в почечных канальцах. Кроме того, КТ устраняет гиперкальциемию, возникающую после приема пищи. Участие КТ в ремоделировании костной ткани признается не всеми исследователями.
Эстрогены
Имеются многочисленные данные о влиянии эстрогенов на всасывание кальция в кишечнике. По мнению большинства исследователей, воздействие эстрогенов па метаболизм кальция и костной ткани осуществляется через увеличение продукции ПТГ, который, в свою очередь, влияет на метаболизм 1,25-(ОН)2D3. Дефицит эстрогенов уменьшает продукцию КТ, изменяет чувствительность костных клеток к ПТГ.
Системные и локальные факторы роста
На метаболизм костной ткани, помимо кальцийрегулирующих гормонов, оказывают влияние системные и локальные факторы роста Системным медиатором, регулирующим число и активность остеокластов, является остеокластактивирующий фактор. Последний в определенных количествах вырабатывается в норме лимфоцитами в присутствии макрофагов, продуцирующих простагландины группы Е. Костная ткань сама является богатым источником факторов роста, которые влияют на процессы резорбции и образования кости. Эти факторы роста главным образом действуют как локальные регуляторы метаболизма костной ткани. Более того, исходная костная клетка, синтезирующая фактор роста, может оказаться и его клеткой-мишенью. К настоящему времени из костного матрикса или культуры кости выделены следующие факторы роста: фактор роста фибробластов, который разделяется на кислотный и щелочной и индуцирует остеогенез; инсулиноподобный фактор роста, повышающий способность костно-мозговых клеток (предшественники) образовывать костную ткань in vitro; трансформирующий фактор роста присутствует в костном матриксе и высвобождается в процессе резорбции. Этот фактор ингибирует действие остеокластов и стимулирует остеобласты. Существует еще ряд факторов, изученных в меньшей степени.
Таким образом, регуляция метаболизма костной ткани в норме является многофакторным процессом, и нарушение одного из компонентов этой системы может привести к развитию остеопороза.
Патогенез системного остеопороза
До настоящего времени нет единого мнения в отношении механизмов нарушения ремоделирования и моделирования при ОП.
В свете теории интермедиарной организации скелета развитие ОП представляется как нарушение временного рассогласования действия отдельных БМЕ, что влечет за собой нарушение процессов резорбции и костеобразования. По мнению других авторов, причина ОП – уменьшение числа функционирующих БМЕ и удлинение жизни отдельных БМЕ, что не является благом, так как скорость ремоделирования и воспроизводство костной ткани замедляются, что нередко описывается как «ленивая кость». Так как физиология составляющих БМЕ клеток определяется биохимическими процессами с участием ферментов, реагирующих на воздействие гормонов, то действие любого эндогенного или экзогенного фактора, вызывающего дефект структурного белка или снижение активности фермента, нарушает скорость реакции и приводит к метаболическим нарушениям. Эти нарушения могут клинически проявиться не сразу, так как наличие компенсаторных механизмов какое-то время нивелирует их, тем более если указанные расстройства незначительны. Но такое напряженное метаболическое состояние декомпенсируется при воздействии факторов риска, нарушающих адаптацию. В этих случаях скорость метаболических процессов либо увеличивается, либо уменьшается и, как следствие, нарушается образование или резорбция кости, в ряде случаев страдают одновременно оба процесса.
Таким образом, в основе развития ОП лежит нарушение внутрикостных механизмов – моделирования и ремоделирования. Как пример ОП, связанного с нарушением моделирования, описывается несовершенный остеогенез, ОП при нарушении питания, при билиарном циррозе и прочих причинах. Остеопороз как следствие нарушения ремоделирования развивается при кратковременной гипокинезии, тиреотоксикозе, приеме стероидов и пр. причинах.
В развитии заболевания выделяют два момента: остеопению и механическую несостоятельность костной ткани. При остеопении механическая прочность остается достаточной, чтобы выдержать физиологические нагрузки. Появление перестроечных переломов связывается с развитием механической несостоятельности из-за замедленного заживления микропереломов. В норме в костной ткани происходят микропереломы трабекул, которые активизируют ремоделирование, а это, в свою очередь, способствует их заживлению. В силу ряда причин, действующих на клетки БМЕ, этот механизм при ОП нарушается, число переломов костных балок увеличивается. При этом срабатывает принцип обратной связи; накопление микропереломов усугубляет механическую несостоятельность кости.
Изменения кальцийрегулирующих гормонов при остеопорозе
Паратгормон
Данные относительно уровня ПТГ при остеопорозе противоречивы. Наряду с нормальным или даже повышенным содержанием нередко описывается и снижение его уровня. Снижение секреции ПТГ отмечено при ОП на фоне гипокинезии. По мнению ряда авторов, единичные сообщения об увеличении уровня ПТГ у больных ОП, например при постменопаузальной форме, объясняются тем, что не учитывается возможность возрастного, характерного для нормы его увеличения. Известные данные о способности остеобластов влиять на синтез ПТГ в какой-то мере объясняют снижение уровня гормона у больных ОП с выраженной клеточной депрессией.
Кальцитонин
Большую частоту ОП у женщин белой расы связывают с более низким, чем у черных женщин, уровнем КТ. Как считают некоторые исследователи, КТ влияет на развитие ОП только после наступлении менопаузы. В то же время сообщения о влиянии КТ на созревание хондроцитов свидетельствуют о более широком спектре его действия. Данные относительно изменений уровня КТ при ОП противоречивы. Отмеченное снижение подтверждается не всеми авторами.
Витамин D и его метаболиты
Нарушение процессов моделирования, ремоделирования и функции клеток, участвующих в гистогенезе, связывают с недостатком активных метаболитов витамина D. Данные об изменении уровня метаболитов витамина D при ОП, так же как и сведения, относительно изменения уровня ПТГ и КТ, носят противоречивый характер.
Эстрогены
О возможном влиянии недостатка эстрогенов на развитие ОП впервые высказался Albright. Однако до настоящего времени их воздействие на костную ткань остается предметом дискуссии. Мнение о способности эстрогенов тормозить резорбцию и тем самым предотвращать потерю костной ткани больных ОП, не является общепризнанным В ведущей роли эстрогенов в генезе заболевания заставляет усомниться то, что ОП не является неизбежностью для каждой женщины в менопаузе, и увеличение в последние годы числа больных среди женщин молодого и среднего возраста с нормальным менструальным циклом и сохранением детородной функции, а также значительный рост числа больных среди мужчин.
Факторы риска развития остеопороза
Одним из факторов риска развития ОП является снижение величины пиковой костной массы Пиковая масса – максимальное количество костной ткани, которая может быть достигнута в данном участке скелета. Пик костной массы достигается к 18-летнему возрасту. Определение маркеров костеобразования (остеокальцин) и резорбции (пиридинолин) подтвердило, что пик этих показателей имеет место у подростков. К 20 годам скорость накопления костной массы уменьшается. В последних исследованиях показано, что с 20 до 35 лет величина костной массы не меняется (период «плато»). По мнению большинства исследователей, критическими периодами для формирования костной массы являются первые 3 года жизни ребенка и препубертатный период. На формирование пика костной массы оказывает влияние физическая активность, которая должна носить адекватный характер. Достижение нормального пика костной массы зависит и от количества потребляемого кальция. Суточная потребность кальция у детей и подростков не менее 1200 мг/сут. Пиковая костная масса во многом предопределена генетически. Изучение минеральной плотности клиникогенеалогическим методом выявило выраженную корреляцию минеральной плотности при сравнении поколений.
Таблица 1. Суточная потребность в кальции в разные возрастные периоды, а также при некоторых физиологических состояниях
| Группы здоровых лиц | Потребность в кальции, мг/сут |
| Дети | 800-1000 |
| Подростки | до 1300 |
| Предменопаузальный и период | 1000 |
| Постменопаузальный период | 1500 |
| Беременность | 1500 |
| Гипокинезия | 2000 |
Недостаточное потребление кальция. По данным В.А. Тутельтяна и Б.П. Суханова, суточная потребность кальция (мг/сут) составляет для детей в возрасте 3 мес. 400, 4-6 мес. – 500, 7-12 мес. – 600, 1-3 года – 800, 4-6 лет – 900-1000, 7-10 лет – 1100 и 11-17 лет – 12001300 мг/сут.
Гиподинамия
Ограничение физической нагрузки нивелирует процессы моделирования и ремоделирования, изменяя функцию БМЕ, и приводит к остеопении. При гипокинезии снижается число остеобластов, они теряют свое упорядоченное расположение. У молодых людей полная неподвижность в течение 4 месяцев может вызвать снижение минеральной плотности до 20%.
Высокое потребление фосфора
Увеличение потребления фосфора с пищей приводит к гиперфосфатемии и может стать причиной ОП, вызывая, с одной стороны, гипокальциемию, с другой – оказывая непосредственное тормозящее воздействие на костеобразование. К увеличению уровня фосфора в крови может привести и инсулинотерапия, так как под влиянием инсулина увеличивается поглощение фосфора в тонком кишечнике.
Употребление алкоголя
Повышенное содержание алкоголя в крови оказывает повреждающее влияние на остеобласты, усиливает (кратковременно) функцию коры надпочечников. Глюкокортикоиды, оказывая прямое действие на околощитовидные железы, способствуют увеличению секреции ПТГ. Кроме того, глюкокортикоиды угнетают всасывание Са из кишечника, нарушают метаболизм витамина D и усиливают экскрецию Са с мочой. Многократное повторение этого воздействия приводит к развитию остеопороза.
Генетические факторы
Потенциально важны генетические исследования для выявления риска остеопорозных переломов. Если будет возможным идентифицировать полиморфизм, который предскажет низкую плотность кости или остеопорозные переломы, это может быть использовано как скрининговый инструмент для идентификации людей с таковым риском и для назначения им профилактического лечения. Это также может дать основу для составления тестов для проверки эффективности лечения. Например, показано, что ответ костной массы на добавление в диету витамина D и кальция в значительной мере зависит от полиморфизма рецептора для витамина. Подобным образом применение полиморфных маркеров для других генов-кандидатов может выявить лучшую реакцию на заместительную гормонотерапию, бифосфонаты и изменения в образе жизни.
Таблица 2. Изучение генетического влияния в процессе остеопороза
| Изучаемый ген | Значение для определения |
| Рецептор витамина В | Через рецептор витамин регулирует дифференцировку клеток кости, оборот кости и гомеостаз кальция |
| Рецептор эстрогенов | Через рецептор эстрогены регулируют оборот кости и рост скелета |
| Трансформирующий фактор | Присутствует в матриксе кости и обеспечивает связь между резорбцией кости и рост костеобразованием |
| Интерлейкин 6 | Регулирует дифференцировку остеокластов и медиирует некоторые влияния половых гормонов на кость |
| Ген коллагена тип I | Тип I коллагена преобладает среди белков кости |
| Коллагеназа | Энзим, участвующий в резорбции костного матрикса |
В последние годы существует мнение, что «плохое качество» кости и ее невысокая масса – основные факторы риска развития ОП. Другими словами, тот «пик костной массы», который формируется к 20 годам, является «краеугольным камнем» возникновения и развития ОП, его выраженности в более поздние возрастные периоды жизни.